【解题策略】用“交叉”法则分析“强酸制弱酸”的原理,用“交叉”法则分析“强酸制弱酸”的原理。
学生熟悉强酸制弱酸的规律,但当反应物酸“过量”或“少量”时,生成的盐是“正常盐”还是“酸式盐”,学生往往感到困惑。
例2 (1)在Na2CO3溶液中加入少量HF溶液,反应离子方程式为(数据见表1,下同);如果加入过量的HF溶液,反应离子方程式为:
(2)向氰化钠溶液中通入少量CO2,反应离子方程式为。
解析:根据“强酸+弱酸盐=弱酸+强酸盐”原理,将此原理转化为如下“十字”形式:

叫做“十字”法则(实线连接反应物,虚线连接产物),这样反应的产物就一目了然了。它直观地体现了反应原理中的“逼弱”原则,这种“交叉”规律同样适用于氧化还原反应。
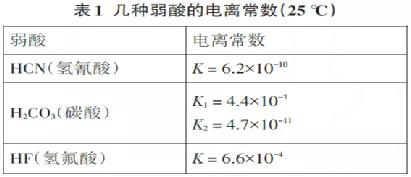
从表1中的数据,得出以下结论和形式:
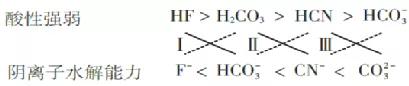
根据“交叉”法则,很容易知道以下反应:
(ⅰ)HF+HCO 3-= F-+CO2 ↑+ H2O;
(二)CO2+H2O+CN-= HCO3-+HCN(无论CO2有多少,都只生成HCO 3-);
(三)HCN+Co32-= HCO3-+CN-(无论HCN有多少,都只产生HCO3-)。
还有结论:(ⅳ)HF+CN-= F-+HCN;(ⅴ) HF(少量)+Co32-= HCO3-+F-。
如果加入过量的HF溶液,则为2HF(过量)+Co32-= 2F-+CO2 ↑+H2O。这是因为在反应(ⅴ)中产生的碳酸氢钠与过量的HF (I)反应,HF+HCO3-= F-+CO2 ↑+H2O,混合物为2HF(过量)+Co32-= 2F。