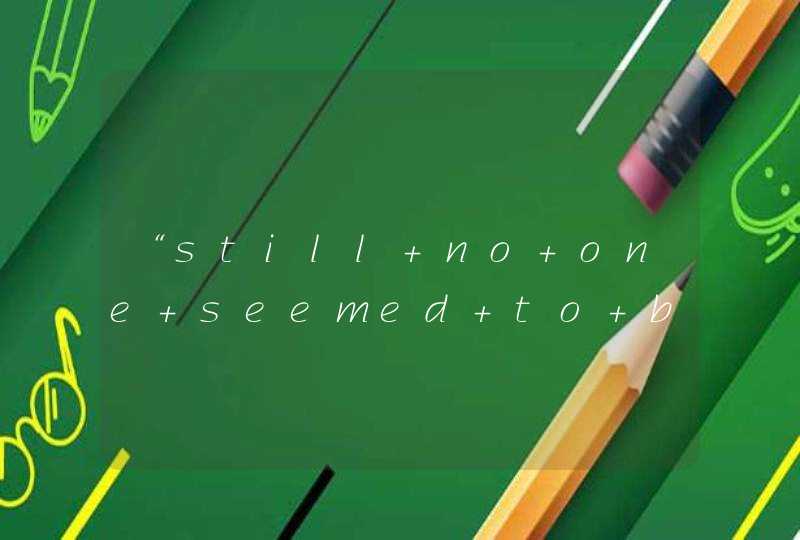1判断原则①c(H+)=c(OH-),溶液显中性;②c(H+)>c(OH-),溶液显酸性;③c(H+)<c(OH-),溶液显碱性2判断规律①强酸强碱盐的水溶液显中性;②强酸弱碱盐的水溶液显酸性;③弱酸强碱盐的水溶液显碱性(说明:对于弱酸弱碱盐水溶液的酸碱性,比较复杂,高中不要求掌握这里从略)3理论解析①强酸强碱盐:是指由强酸与强碱发生中和反应而生成的盐,如NaCl它在水溶液中,阴、阳离子都不发生水解,溶液中c(H+)=c(OH-)因此,强酸强碱盐的水溶液显中性②强酸弱碱盐:是指由强酸与弱碱发生中和反应而生成的盐,如CuCl2它在水溶液中,阳离子(Cu2+)能发生水解,与水电离出来的OH-结合生成弱电解质Cu(OH)2,从而促进水的电离,结果使溶液中c(H+)>c(OH-)因此,强酸弱碱盐的水溶液显酸性;③弱酸强碱盐:是指由弱酸与强碱发生中和反应而生成的盐,如Na2CO3它在水溶液中,阴离子(碳酸根离子即CO32-)能发生水解,与水电离出来的H+结合生成弱电解质HCO3-,从而促进水的电离,结果使溶液中c(H+)<c(OH-)因此,弱酸强碱盐的水溶液显碱性总之,“强强不水解(显中性),谁弱谁水解,谁强显谁性”
酸碱性和酸碱度有何不同怎样测定溶液的酸碱性和酸碱度
酸碱性是定性地表示某溶液呈酸性还是呈碱性;而酸碱度是定量地表示某种溶液酸性或碱性强弱的程度
测定溶液的酸碱性,通常是在溶液中滴入几滴酸碱指示剂,如石蕊试液或酚酞试液,石蕊由紫变红表示溶液呈酸性,石蕊由紫变蓝或酚酞由无色变为红色表示溶液呈碱性
粗略地测定溶液的酸碱度可以用pH试纸,测定的方法是将待测定溶液滴在pH试纸上(注意:不可将pH试纸浸入溶液中,也不能用水先将pH试纸润湿),然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH常用的稀溶液的pH范围一般在0~14之间,pH小于7的呈酸性,大于7的呈碱性,pH越小酸性越强,pH越大碱性越强
1、用无色酚酞可以辨别碱性溶液,如果溶液呈现碱性,酚酞就会变红色调
用紫色石蕊可以辨别酸性溶液,如果溶液呈现酸性,石蕊就会变红色调
用ph试纸可以判断溶液的酸碱性的强弱,试纸遇溶液后颜色越红,酸性越强,越蓝则碱性越强
2、鉴定氢离子
取少量待测液
加入紫色石蕊试剂
溶液变为红色
则说明该溶液中有氢离子存在
鉴定氢氧根离子
取少量待测液
加入酚酞试剂
溶液变为粉红色
则说明该溶液中有氢氧根离子存在
如何辨别盐溶液的酸碱性:前提:可溶。看属于哪复种盐类,(规律:谁强显谁性)
强酸弱碱盐,其盐溶液显酸性,例:CuCl2溶液,显酸性,盐酸是强酸,氢氧制化铜是弱碱。
强碱弱酸盐,其盐溶液显碱性,例:Na2CO3溶液,显碱性,氢氧化钠是强碱,碳酸是弱酸。
强酸强碱盐,弱酸弱碱盐,其盐溶液都显中性,例:NaCl溶液。
HCl、H2SO4、HNO3是强酸,KOH、NaOH、Ba(OH)2、Ca(OH)2都是强碱。(目前我知道的只百有这些) 强弱酸,强弱碱一般是要记得。比如:氢氧化钠、氢氧化钙/钡/钾,这5个都是强碱。三强酸:硫酸、盐酸、硝酸。(我目前知道的只有这些,初中的话知道这些常见的就可以了)其他的度一般都是弱碱或弱酸。亚硝酸是弱酸。
更多内容可以看看科学高分网 溶液的酸碱性
以上就是关于如何判断溶液的酸碱性全部的内容,包括:如何判断溶液的酸碱性、溶液的酸碱性和酸碱度有什么区别、有哪些方法可以鉴别溶液的酸碱性等相关内容解答,如果想了解更多相关内容,可以关注我们,你们的支持是我们更新的动力!