首先,几种简单的碳物质
1.钻石(C)是自然界中最坚硬的物质。它可以用来制造钻石,雕刻玻璃,钻孔机的钻头等。
2.石墨(C)是最软的矿物之一,具有极好的导电性和润滑性。可用于制作铅笔芯、干电池电极、电动车滑板等。
金刚石和石墨的物理性质之所以差别很大,是因为碳原子的排列方式不同。
CoCO2和CoCO2化学性质差异大的原因是分子的组成不同。
3.无定形碳:由石墨的微小晶体和少量杂质组成,主要有焦炭、木炭、活性炭、炭黑等。
活性炭和木炭有很强的吸附性,焦炭用于炼铁,橡胶中加入炭黑可以增加轮胎的耐磨性。

二。元素碳的化学性质:
元素碳的物理性质不同,但是各种元素碳的化学性质是完全一样的!
1.室温下稳定性强
2.可燃性:
完全燃烧(足够的氧气)产生CO2: C+O2点燃CO2。
不完全燃烧(氧气不足),导致CO: 2C+O2点燃2CO
3.还原性:2Cu高温2Cu+CO2↑(置换反应)应用:冶金工业
现象:黑粉逐渐变成鲜红色,石灰水变浑浊。2Fe2O3+3C高温4Fe+3CO2↑
三。二氧化碳的制备
1.实验室造气的思路:(原理、装置和检验)
(1)发生器:由反应物状态和反应条件决定;
反应物是固体,需要加热。制造气体时,用高锰酸钾制造O2。
反应物是固体和液体,不需要加热。制造气体时,使用制造H2的发电机。
(2)收集方法:气体的密度和溶解度决定:
不溶于水的一氧化碳只能通过排水收集。
密度空气体高于空气体。向上空气体法只能用于CO2。
如果密度低于空气体的密度,则使用向下放电空气体法。
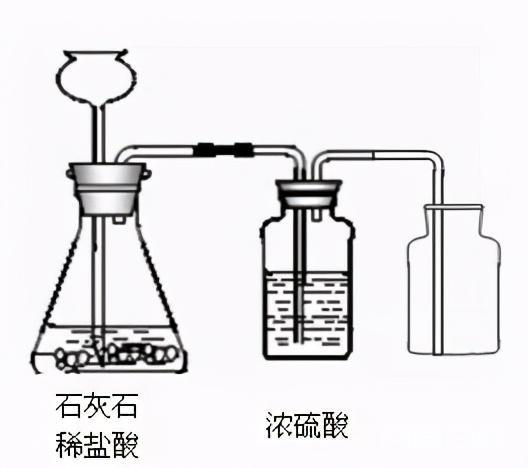
2.二氧化碳的实验室制备
1)原理:石灰石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑。
2)选择与制氢相同的发电机。
3)集气法:上排空集气法。
4)验证方法:将配制好的气体通入澄清的石灰水中,若浑浊则为二氧化碳。
全检法:将点燃的木条放入气瓶口,木条会熄灭。证明已经收集到二氧化碳气体。
3.二氧化碳的工业生产方法:
煅烧石灰石:CaCO3,高温CaO+CO2↑
生石灰与水反应得到熟石灰:CaO+H2O=Ca(OH)2
四。二氧化碳的性质
1.物理性质:无色无味的气体,密度比空气体高,易溶于水,高压低温下可得到固体-干冰。
2.化学性质:
1)一般不能燃烧,不支持燃烧,不能供给呼吸。
2)与水反应生成碳酸:CO2+H2O==H2CO3。生成的碳酸能使紫色石蕊试液变红。
H2CO3 == H2O+ CO2↑碳酸不稳定,易分解。
3)能使澄清石灰水浑浊:CO2+Ca (OH) 2 = = CaCO3+H2O。这个反应是用来测试二氧化碳的。
4)在高温2CO下与热碳:C+CO2反应
(吸热反应,以CO2为氧化剂,C为还原剂,既是化合反应又是氧化还原反应)
3.用途:灭火(灭火器原理:Na2CO3+2HCl==2NaCl+H2O+CO2↑)
利用它的物理特性和化学特性。
干冰用于人工降雨和制冷剂。
温室肥料
4.环境影响:过量排放导致温室效应。
动词 (verb的缩写)一氧化碳
1.物理性质:无色无味气体,密度略小于空气体,不溶于水。
2、有毒:吸入肺部与血液中的血红蛋白结合,使人体因缺氧而中毒。
3.化学性质:(H2、一氧化碳和碳具有相似的化学性质:①可燃性②还原性)
1)可燃性:2CO+O2点燃2CO(点火前必须检查可燃气体的纯度)
H2和氧气的燃烧火焰是淡蓝色的火焰。
CO2的燃烧火焰是蓝色火焰。
CH4和O2的燃烧火焰发出明亮的蓝色火焰。
识别:H2、一氧化碳、甲烷可燃气体:看燃烧产物(不根据火焰颜色)
(水煤气:H2和一氧化碳的混合气体C+H2O在高温下H2+一氧化碳)
2)还原性:CO+CuO △ Cu+CO2(非取代反应)应用:冶金工业
现象:黑色氧化铜逐渐变成鲜红色,石灰水变浑浊。
Fe2O3+3CO高温2Fe+3CO2(现象:红棕色粉末逐渐变黑,石灰水变浑浊。)
除杂:将CO[CO2]通入石灰水或氢氧化钠溶液中:CO2+2NaOH==Na2CO3+H2O
CO2[CO]通过热氧化铜CO+CuO △ Cu+CO2。
CaO[CaCO3]只能煅烧(不能加盐酸)。CaCO3可以在高温下煅烧。CaO+CO2↑。
注:检查CaO是否含有CaCO3加盐酸:CaCO3+2HCl==CaCl2+H2O+CO2↑。
(CO32-):先加入盐酸,然后将产生的气体引入澄清石灰水。)



